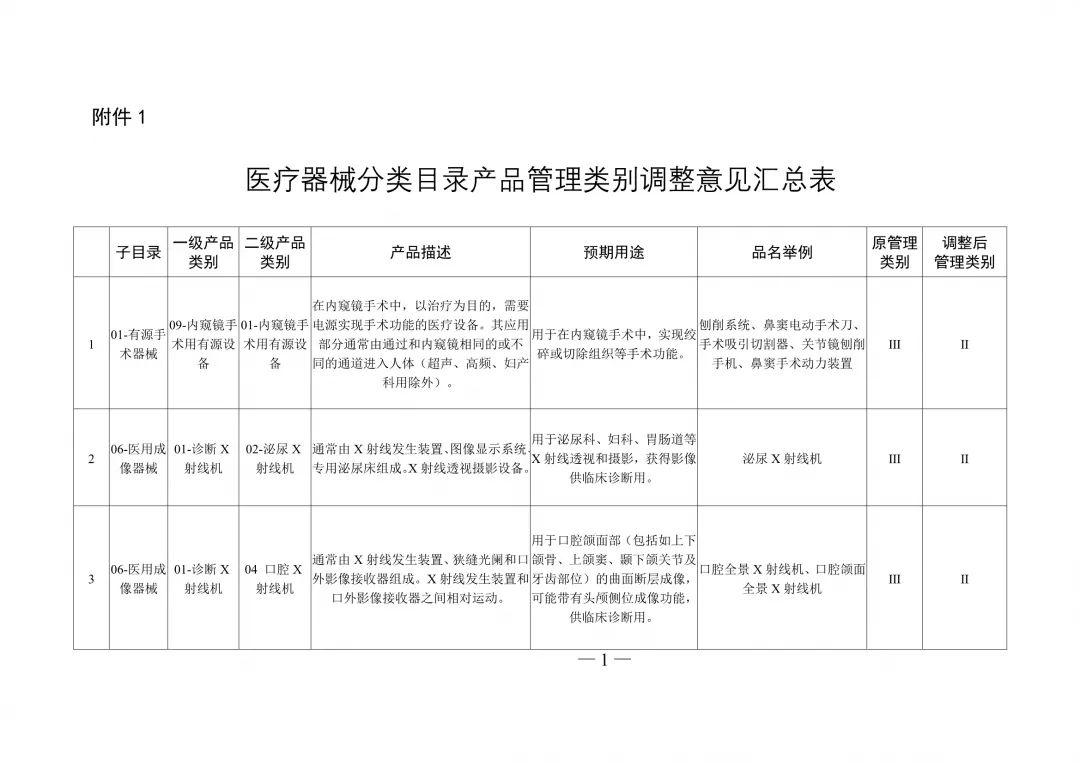
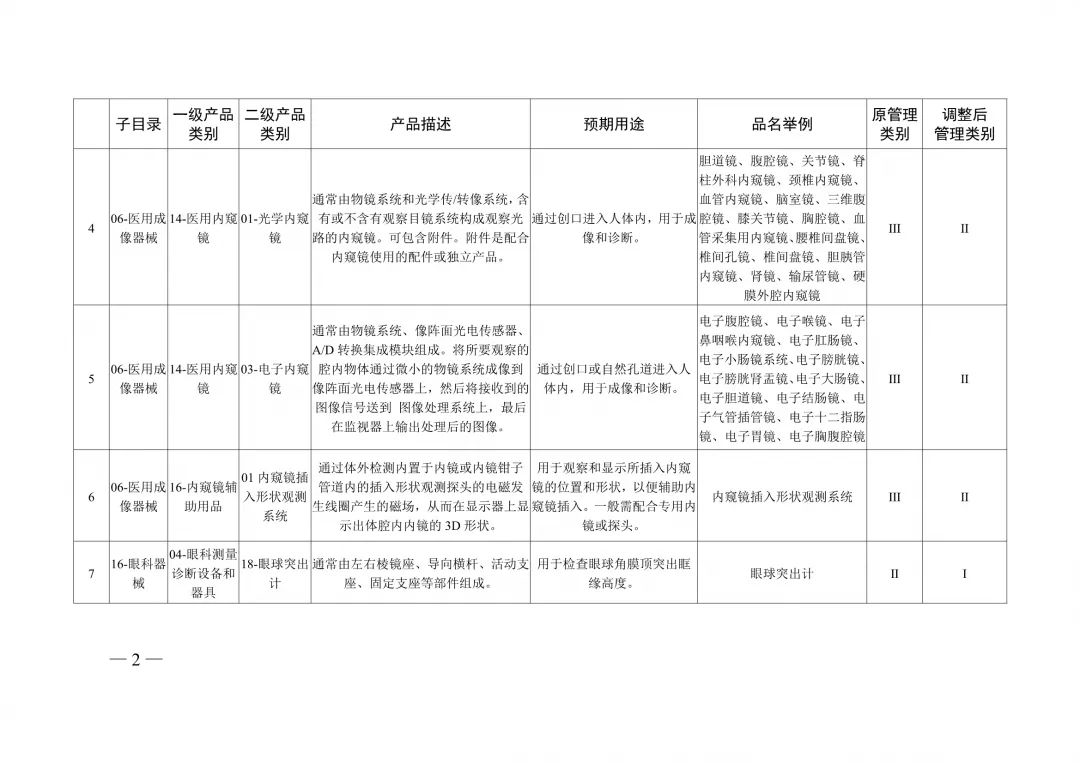
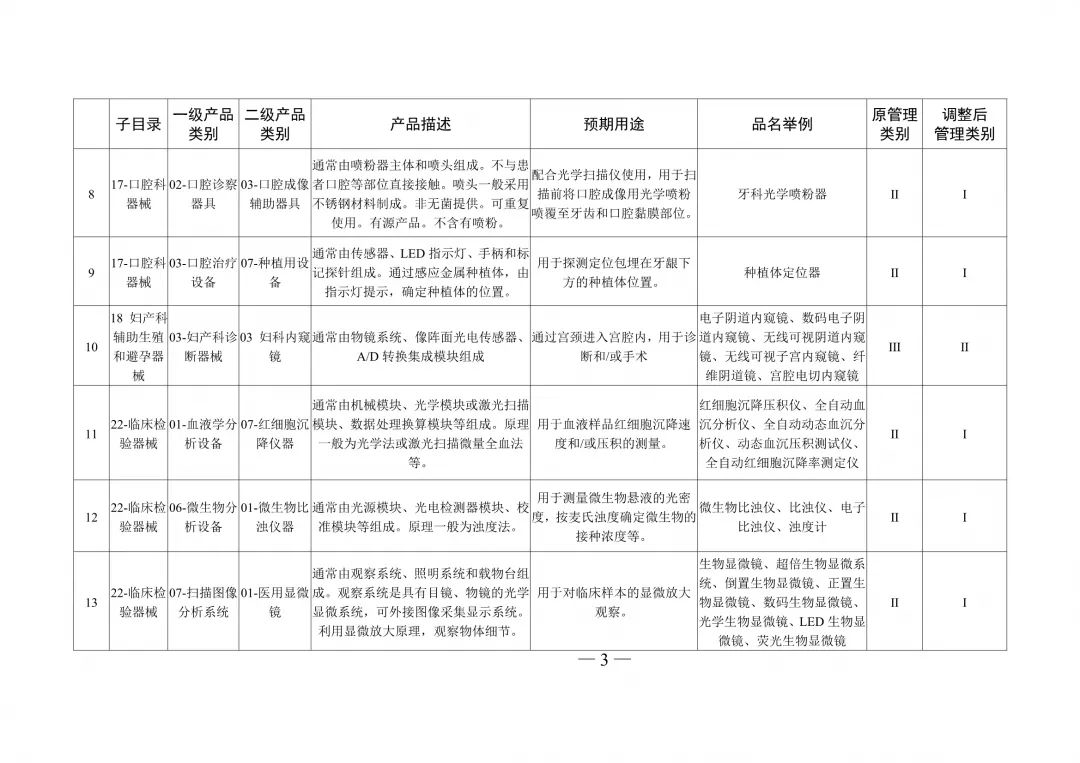
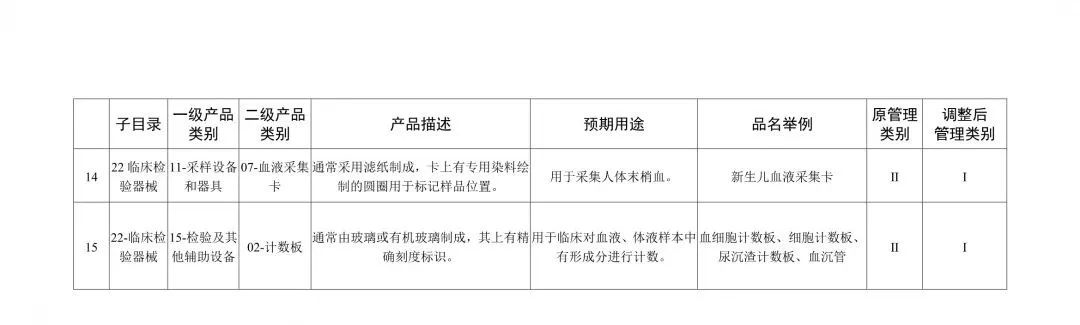
醫療器械分類目錄重大調整!
5月8日,國家藥品監督管理局發布了《關于醫療器械分類目錄動態調整工作程序的公告(2021年第60號)》,醫療器械分類管理目錄將更加科學、合理、規范。
《分類目錄》動態調整包括以下情形:
(一)調整子目錄;
(二)調整一級產品類別、二級產品類別和/或管理類別;
(三)增補有代表性的創新醫療器械產品;
(四)刪除不再作為醫療器械管理的產品;
(五)修訂產品描述、預期用途和品名舉例等內容。
境內醫療器械注冊人和備案人、生產經營企業、使用單位可以向所在省(區、市)藥品監督管理部門提出《分類目錄》調整建議;
境外醫療器械注冊人和備案人可以委托其境內代理人,向其代理人所在省(區、市)藥品監督管理部門提出《分類目錄》調整建議。
企業相關人員提交調整材料后,由省(區、市)藥品監督管理部門負責對行政區域內《分類目錄》調整建議進行初審,認為確需調整的,將調整建議報國家藥監局醫療器械標準管理中心(以下簡稱標管中心)。
除了企業提交調整建議外,國家藥監局相關部門、省(區、市)藥品監督管理部門,醫療器械相關學會、協會等社會團體,國家藥監局醫療器械分類技術委員會委員,也可向標管中心提出《分類目錄》調整建議。
《分類目錄》調整建議和相關材料應當通過標管中心分類界定信息系統提交,相關材料包括但不限于以下內容:
(一)擬調整的內容和理由;
(二)擬調整產品國內外管理屬性、類別和產業現狀;
(三)擬調整產品主要風險點及風險變化等情況;
(四)擬調整產品技術特點、與已上市同類產品的比較和臨床使用等情況;
(五)擬調整產品不良事件和上市后監管有關情況(如適用)。
當標管中心收到《分類目錄》調整建議后應當及時進行研究,基于對產品風險變化情況的分析、評估,參考國際醫療器械分類實踐,結合我國監管實際,綜合研判形成初步調整意見。再將《分類目錄》初步調整意見在其網站向社會公開征求意見1個月。根據征求意見情況,修改完善形成《分類目錄》擬調整意見。
針對《分類目錄》子目錄的擬調整意見,由標管中心報國家藥監局。國家藥監局組織分類技術委員會執委會審議。審議通過后將擬調整意見在國家藥監局網站公示7日,公示后按程序發布。
針對其他情形的《分類目錄》擬調整意見,由標管中心組織分類技術委員會專業組審議。審議通過后將擬調整意見報國家藥監局。國家藥監局將擬調整意見公示7日,公示后按程序發布調整公告。
《分類目錄》根據需要進行調整,調整工作原則上每年不少于一次。已注冊/備案醫療器械管理類別調整后的注冊/備案事項,按照《醫療器械注冊管理辦法》等有關要求執行。體外診斷試劑分類子目錄動態調整工作參照本程序執行。